|
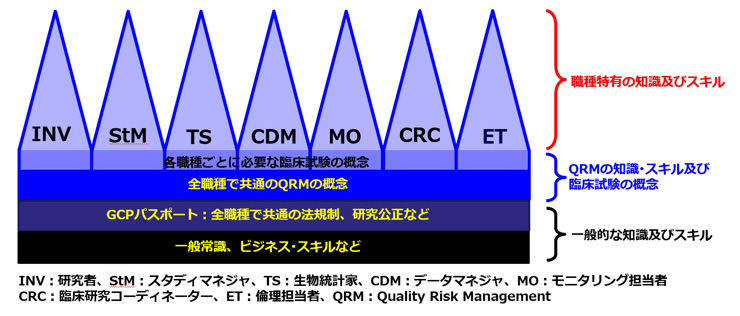
臨床試験専門職種の質の維持・向上を目指すスタディマネジャー(StM)、臨床データマネジャー(CDM) 日本臨床試験学会 日本臨床試験学会(JSCTR)では、スタディマネジャー(StM)、臨床データマネジャー(CDM)及びモニタリング担当者(MO)の検定並びに認定制度を新たに発足することになりました。改めて、JSCTRにおける臨床試験の推進と質の向上を図ることを目的とした臨床試験専門職種の人材育成及び新たな検定並びに認定制度発足にいたる経緯について以下に説明させていただきます。 日本臨床試験学会(JSCTR)における臨床試験専門職種の人材育成 日本臨床試験学会(JSCTR)は、臨床試験・臨床研究(以下、臨床試験)に携わる専門職全体の知識と技術の向上をはかり、職種の枠を超えた情報交換と研究活動を推進することで、我が国の臨床試験の推進及び質の向上に寄与することをミッションとしています。 JSCTRで体系化している臨床試験専門職種に必要な知識及びスキルの概念は、一般常識、ビジネス・スキルをプラットフォームとして、臨床試験を実施するために全職種に共通して必要な法規制、研究公正、臨床研究の進め方、Quality Risk Management(QRM)を含む一般知識の上に各職種に特有の専門知識及びスキルを加えて構成されています(図1)。JSCTRでは、新たにStM、CDM及びMOの各職種に求められる知識・スキル及びコンピテンシーを整理するとともに、各職種で基盤とする知識体系を適切に選択してテキストブックを作成しています。これらのテキストブックに従って必要な研修を整備し実施するとともに、臨床試験チームで各職種がその役割を果たすことができるように一貫した研修・教育プログラムも提案し実践していきます。
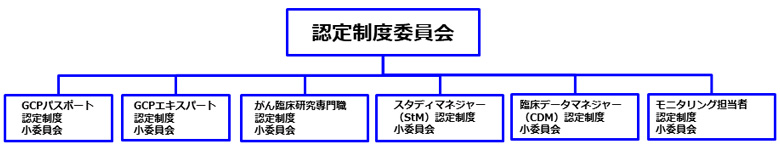
図1 臨床試験の実施に必要な知識及びスキルに関する概念 新たな検定並びに認定制度について 上記の体系化された各職種に求められる知識・スキルの習熟度を図るために、この度、JSCTRではStM、CDM及びMOの3職種について新たな検定・認定制度を構築することとし、これらの認定制度を企画・立案、実施・運営するために認定制度委員会内に各認定制度にかかる業務を遂行する小委員会を設置し、既存のGCPパスポート、エキスパート及びがん臨床研究専門職の各認定制度についても小委員会を設置することで委員会の組織再編を行いました(図2)。認定制度委員会では、担当理事及び委員長が中心となって各小委員会の委員長で構成する会議体を定期的に開催することにより各小委員会の活動を一括管理する体制を整え、各認定制度の円滑な運営に努めています。
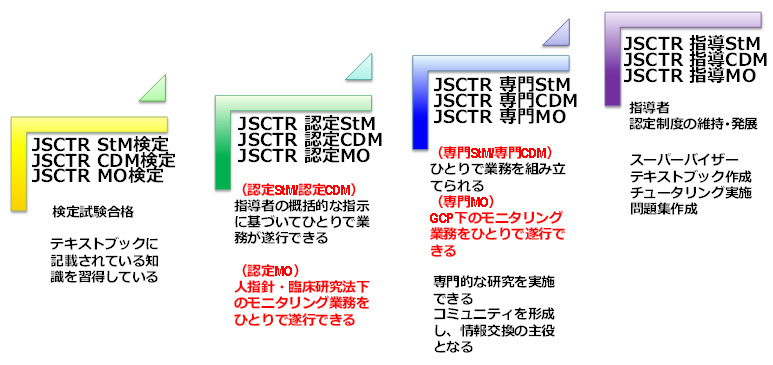
図2 認定制度委員会・小委員会 新たに設置するStM、CDM及びMOの各職種の検定では、臨床試験チームで専門職種として求められる基本的な知識の充足性を検定試験により評価します。検定試験においては、各職種の認定制度小委員会が作成する検定試験に関する規定で定める点数以上を得点した者を検定合格者とし、検定合格証を発行します。検定合格者は、あくまでも必要な知識を習得していることを示すのみであり、臨床試験チームにおいて専門職種として必要な役割を実際に果たす活動ができることを認めるものではありません。臨床試験チームでは、各職種に役割があり、チームのメンバーが何を実施すべきなのかを相互に理解することが大切であるとともに、各専門職種に必要とされる知識を相互に理解した方のなかから、StM、CDM又はMOの専門職種の更なる知識と臨床試験チームで活躍していただくために必要なスキルを習得していただく機会を提供することを目的として検定試験を設定しました。
図3 StM、CDM、MOの検定・認定制度の概要 1. スタディマネジャー(StM) 1.1. JSCTR StM検定試験 StMは臨床試験チームにおいて、その臨床試験をマネジメントする業務(スタディマネジメント業務)を遂行するためには、コアコンピテンシー1)に加えて、プログラムマネジメント及びプロジェクトマネジメントに関する知識を有していることが必要です。
1.2. JSCTR StM認定試験 JSCTR認定StMは、臨床試験チームにおいて一定以上の経験を有し、StMに求められる役割を概括的な指示に基づいて、ひとりで果たすことができることが必要です。 2. 臨床データマネジャー(CDM) 2.1. JSCTR CDM検定試験 CDMは臨床試験チームにおいて、臨床試験のデータ及び関連するステークホルダーなどのプロジェマネジメントをする業務(臨床データマネジメント業務)を遂行するための臨床データマネジメントに関する知識を有していることが必要です。グローバルにおいては、Society for Clinical Data Management(SCDM)がコンピテンシー調査、及びそれに基づく教本Good Clinical Data Management Practice(GCDMP)の発刊を継続しています。国内では、2019年度・2020年度AMED中央IRB事業において、CDMとして必要なコンピテンシー調査と、CDM対象の教育プログラムを開発しています。今回は、その成果物及び、GCDMPを基礎としたJSCTR CDM検定制度を策定しています。 2.2. JSCTR CDM認定試験 JSCTR認定CDMは、臨床試験チームにおいて一定以上の経験を有し、CDMに求められる役割を概括的な指示に基づいて、ひとりで果たすことができることが必要です。JSCTR CDM検定試験合格者のうちJSCTR CDM認定試験においてCDM認定制度小委員会が作成する認定試験に関する規定で定める点数以上を得点した者をJSCTR認定CDMとして認定する予定です。 3. モニタリング担当者(MO) リソースが限られている研究者主導臨床研究ではモニタリングをCRO等に業務委託することが困難な場合が多く、多くの臨床研究のモニタリングはアカデミア所属員により実施されています。また治験でモニタリングを実施する企業やCRO所属モニターについては各企業やCRO協会による認定制度が存在しますが、治験以外の臨床研究でモニタリングを実施するモニターを対象とした認定制度は存在しません。以上を踏まえ、本学会によるモニタリング担当者の検定・認定の対象は、人を対象とする生命科学・医学系研究に関する倫理指針(以下人指針)や臨床研究法下で実施する臨床試験におけるモニタリング担当者としました。なお、医師主導治験等のGCP下で実施する治験を担当するモニタリング担当者については、今後専門モニタリング担当者としての制度設計を継続して検討していきます。
3.1. JSCTR MO検定試験 JSCTRモニタリング担当者検定試験は、臨床試験に関する基本的知識(GCPパスポート相当)及び今後発刊予定の「だれでもわかる臨床試験のモニタリング:JSCTRモニタリング担当者テキストブック」に記載されている臨床試験における基本的な品質マネジメントとモニタリングに関する知識についてその習熟度を評価するために実施します。 3.2. JSCTR MO認定試験 JSCTRモニタリング担当者認定試験は、臨床試験に関する基本的知識(GCPパスポート相当)及び「だれでもわかる臨床試験のモニタリング:JSCTRモニタリング担当者テキストブック」に記載されている臨床試験における基本的な品質マネジメントとモニタリングに関する知識に加え、人指針及び臨床研究法下で実施する臨床試験におけるモニタリングに関する最新の情報に基づくスキルも評価します。従って受験要件として、一定以上のモニタリング経験や、日本臨床試験学会学術集会等への参加証明を求める方向で検討を進めております。 以 上 |